Fisiología
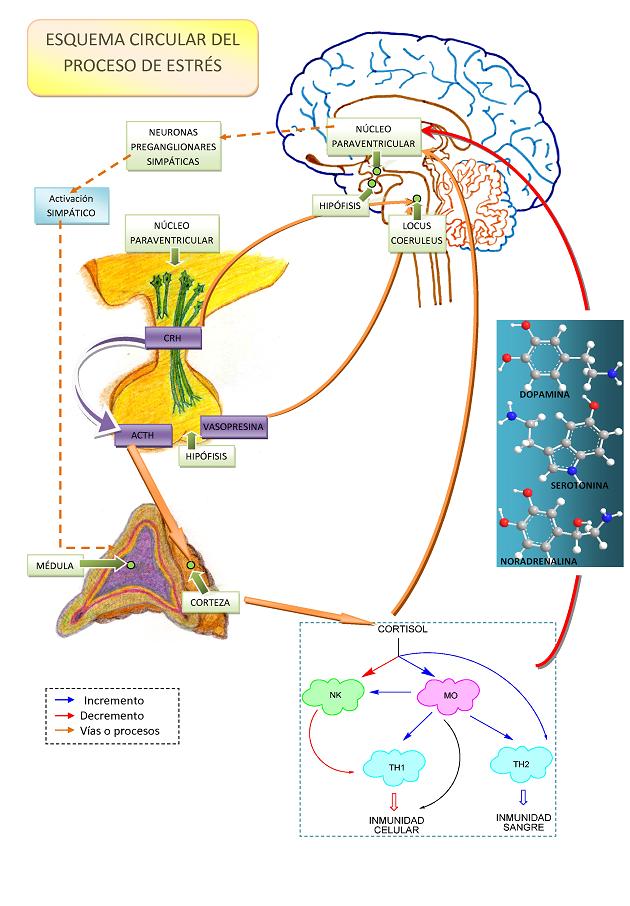
El eje hipotalámico-hipofisario-adrenal (HHA) o sistema hipotálamo-pituitario-adrenal (HPA) constituye un sistema de respuesta a situaciones de estrés. Ante estas, el núcleo paraventricular del hipotálamo libera argenina-vasopresina (AVP) y la hormona liberadora de corticotropina (CRH).
Lo anterior da lugar a que el lóbulo anterior de la glándula pituitaria o hipófisis libere la hormona adrenocorticotropa (ACTH). con ello se induce a la liberación de glicocorticoides en las glándulas suprarrenales, destacando el cortisol. Los glucocortisoles actuaran en retroalimentación disminuyendo la producción de CRH y ACTH. El eje HHA está implicado en la neurobiología de trastornos emocionales y en enfermedades funcionales, como el trastorno de ansiedad, el trastorno bipolar, el síndrome por estrés postraumático, la depresión clínica, el burn-out, el trastorno límite de la personalidad, el síndrome de fatiga crónica y el síndrome del intestino irritable. Algunos neurotransmisores, especialmente la dopamina, la serotonina y la norepinefrina tienen una función reguladora del eje HHA. La oxitocina (OX) inhibe la secrección de ACTH mientras que la AVP actúa liberándola.
Modelos animales
El pez cebra se ha postulado como un modelo prometedor para las enfermedades neuropsiquiátricas complejas. Y ello por (1) manifestar una elevada fecundidad, pequeño tamaño y fácil mantenimiento, (2) presentar un fenotipos conductual bien definidos, siendo un animal social con jerarquías y comportamiento complejo, (3) poseer un eje hipotalámico-pituitario-interrenal (HPI), el cual, se encarga de la respuesta al estrés y cuyos órganos primarios (hipotálamo, hipófisis y corteza suprarrenal) cumplen con funciones y estructuras muy similares al sistema HHA humano [1] y (4) por que cerca del 70% de los genes humanos tienen un análogo en el pez cebra [2].
En tal especie, el gen sam2 se expresa únicamente a nivel cerebral, especialmente en las neuronas dorsales de la habénula, telencéfalo e hipotálamo. Los peces zebra con desactivación del gen sam2 (sam2 KO) mostraron que no se presentaban alteraciones en la embriogénesis, supervivencia en la etapa adulta ni infertilidad. Sí se observó alteraciones en el fenotipo conductual con mayor presencia de ansiedad y miedo con una mayor búsqueda de proximidad social. Los peces cebra sam2 KO mostraron mayores índice de hormona liberadora de corticotropina b (crhb) marcador de desregulación del eje HPI [3]. Igualmente se ha observado una reducción en la preferencia por la novedad social (aproximación a individuos desconocidos) [4].
Se ha documentado que los estados de miedo y ansiedad se relacionan con la sobrexpresión CRH mRNA por el incremento de la excitabilidad de las neuronas del núcleo paraventricular en los mamíferos. Los ratones sam2 KO manifiestan idénticos resultados a los peces zebra [3]. Por otro lado, ratones con desactivación específica de la hormona liberadora de corticotropina hipotalámica (Sim1CrhKO) manifestaron un fenotipo de baja ansiedad [5]. Igualmente la administración de la proteína sam2 incrementa la inhibición post-sináptica de las neuronas CRH nucleoparaventriculares por modulación GABAérgica [3].
Un trabajo previo [6] ya había mostrado que, en los macacos rheus, el antagonismo de los receptores CRH1 con antalarmín reducía las respuestas de ansiedad y miedo manteniendo la conducta de exploración y sexual. Sin embargo el uso de pexacerfont, antagonista selectivo de los receptores CRH1, no mostró, en humanos, resultado superiores al placebo en el tratamiento del trastorno de ansiedad generalizada [7] . Spierling, S.R y Zorrilla,E.P [8] analizan las posibles causas de esta disfunción entre modelos.
Otras líneas de trabajo se han centrado en OX y AVP. Clásicamente ambos nonapéptidos se han asociado al comportamiento social y sus alteraciones y en los últimos años se han establecido como dianas terapéuticas para el autismo, la adicción, la esquizofrenia, la depresión y los trastornos de ansiedad [9] algunas de ellas altamente prevalentes en la discapacidad intelectual. Trataremos de ello en posteriores entradas.
Bibiografía
1.- Avila, L.C. Efecto de la exposición a estrés crónico en la expresión de genes asociados al comportamiento ansiogénico sam2 y nlgn1 en pez cebra (Danio rerio). Tesis presentada como requisito para optar al título de Microbiologa. Universidad de los Andes. Facultad de Ciencias. Departamento de Ciencias Biológicas. Bogotá, Colombia. 2021. https://repositorio.uniandes.edu.co/bitstream/handle/1992/52908/25136.pdf?sequence=1
2.- Howe, K et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 2013; 496(7446): 498–503. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3703927/
3.- Choi, J.H. et al. Targeted knockout of a chemokine-like gene increases anxiety and fear responses. PNAS | Published online January 16, 2018 | E1041–E1050. https://www.pnas.org/content/pnas/115/5/E1041.full.pdf.
4.- Ariyasiri, K., Choi, T, Kim, O., Hong, T.I., Gerlai, R. y Kim, C. Pharmacological (ethanol) and mutation (sam2 KO) induced impairment of novelty preference in zebrafish quantified using a new three-chamber social choice task. Prog Neuropsychopharmacol Biol Psychiatry. 2019;88:53-65. https://pubmed.ncbi.nlm.nih.gov/29958859/
5.- Zhan, R., Asai, M., Mahoney, C.E., Joachim, M Shen, Y., Guner, G. y Majzoub, J.A. Loss of hypothalamic corticotropin-releasing hormone markedly reduces anxiety behaviors in mice. Mol Psychiatry. 2017; 22(5):733-744. https://www.nature.com/articles/mp2016136
6.- Habbib, K.E. et al. Oral administration of a corticotropin-releasing hormone receptor antagonist significantly attenuates behavioral, neuroendocrine, and autonomic responses to stress in primates. PNAS. 2000; 97 (15): 6079-6087.https://www.pnas.org/content/pnas/97/11/6079.full.pdf.
7.- Coric, V. et al. Multicenter, randomized, double-blind, active comparator and placebo-controlled trial of a corticotropin-releasing factor receptor-1 antagonist in generalized anxiety disorder. Depress Anxiety. 2010 May;27(5):417-25. https://pubmed.ncbi.nlm.nih.gov/20455246/
8.- Spierling, S.R y Zorrilla,E.P. Don’t stress about CRF: Assessing the translational failures of CRF1 antagonists. Psychopharmacology (Berl). 2017; 234(9-10): 1467–1481. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5420464/pdf/nihms857864.pdf
9.- Cid-Jofré, V., Moreno, M., Reyes-Parada, M., Renard, G.M. Role of Oxytocin and Vasopressin in Neuropsychiatric Disorders: Therapeutic Potential of Agonists and Antagonists. Int. J. Mol. Sci. 2021, 22, 12077. https://www.mdpi.com/1422-0067/22/21/12077/htm
Saber más
Arroyo, P. (18/03/2016). Hipotálamo, depresión, receptores de glucocorticoides, cortisol, corticosterona, adrenales. Blog NeuronUP. https://blog.neuronup.com/estres-perspectiva-fisiologica/
Muñoz-Collado, S. (28/06/2021). El Sistema Neuroendocrino: hipotálamo, hipófisis y su funcionamiento. Psicoactiva. https://www.psicoactiva.com/blog/sistema-neuroendocrino-funcionamiento/
Deja una respuesta
Lo siento, debes estar conectado para publicar un comentario.