Trabajo de final de máster del Master de Atención Sanitaria y Práctica Colaborativa de la Facultad de Farmacia 2.016-2.017. Se analizaron los datos de prescripciones y dosificaciones comparan las prescripciones observadas durante la implantación de una política de revisión sistemático y uso racional de medicamentos y se comparó con los datos de un periodo anterior también objeto de estudio. Se hipotetizó que tal revisión podía ser la causa en el descenso del consumo. Puede descargarse desde aquí.
Categoría: Farmacología
A partir de los resultados de la evolución en las prescripciones y dosificaciones de 24 personas atendidas en un servicio residencial de diagnóstico dual (discapacidad intelectual y enfermedad mental) se plantea como las decompensaciones psiquiátricas sin derivación, la infrafinanciación y alta rotación del personal las unidades especializadas pueden convertirse en psiquiátricos de bajo coste. Puede descargarse desde aquí.
Se trata de un artículo publicado en la Revista Siglo Cero en que se analiza la evolución en las prescripciones y dosificaciones de 24 personas atendidas en un servicio residencial de diagnóstico dual (discapacidad intelectual y enfermedad mental). Puede descargarse desde aquí.
Se realizó un análisis de la evolución de las prescripciones y dosificaciones en un grupo de 110 personas para el periodo 2.003 a 2.006. Destaca una considerable prescripción y dosificación con tendencia creciente. Se observaros tres clústeres en relación a tales variables. Se presentó en Dincat el 02/11/2010 dentro del marco del Estudio Seneca sobre las características del envejecimiento en la población con discapacidad intelectual. Su versión final es del 29/01/2012. Puede descargarse desde aquí.
Las alteraciones neurobioquímicas se encuentran detrás de un número importante de patologías mentales. La prevalencia de estas es la discapacidad intelectual es superior a la de la población general. La farmacología de la discapacidad intelectual, para nuestra área de interés, la definiremos como:
– Estudio de las alteraciones neurobioquímicas de entidades psicopatológicas propias de la discapacidad intelectual (fenotipo conductual).
– Estudio de posibles especificidades de alteraciones que también se dan el la población general.
– Farmacoepidemiología y Estudios de la Utilización de Medicamentos.
– Evidencias sobre efectividad de las intervenciones farmacològicas.

Reyes-Morillas, R (05/02/2020). La polimedicación asociada a la discapacidad intelectual [Entrada de blog]. Experiencias. Recuperado de https://www.asociacionsanjose.org/la-polimedicacion-asociada-a-la-discapacidad-intelectual/
Pol-Yanguas, E (28/07/2018). efectos adversos de los psicofármacos en una población de adultos con discapacidad intelectual [Entrada en un blog]. Blog de psicofarmacologia critica y otras terapias farmacologicas. Recuperado de http://www.tecnoremedio.es/2018/07/efectos-adversos-de-los-psicofarmacos.html
Fisiología
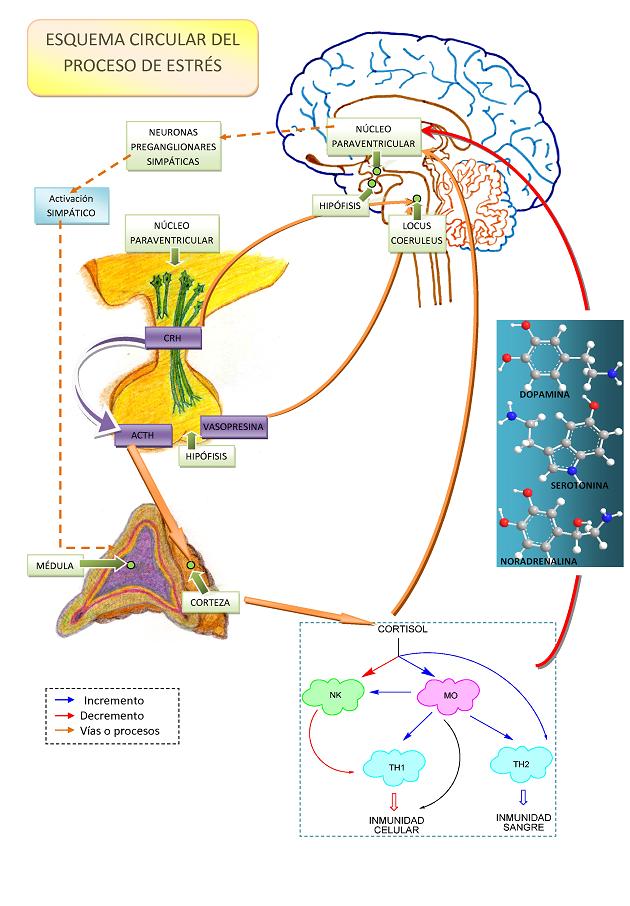
El eje hipotalámico-hipofisario-adrenal (HHA) o sistema hipotálamo-pituitario-adrenal (HPA) constituye un sistema de respuesta a situaciones de estrés. Ante estas, el núcleo paraventricular del hipotálamo libera argenina-vasopresina (AVP) y la hormona liberadora de corticotropina (CRH).
Lo anterior da lugar a que el lóbulo anterior de la glándula pituitaria o hipófisis libere la hormona adrenocorticotropa (ACTH). con ello se induce a la liberación de glicocorticoides en las glándulas suprarrenales, destacando el cortisol. Los glucocortisoles actuaran en retroalimentación disminuyendo la producción de CRH y ACTH. El eje HHA está implicado en la neurobiología de trastornos emocionales y en enfermedades funcionales, como el trastorno de ansiedad, el trastorno bipolar, el síndrome por estrés postraumático, la depresión clínica, el burn-out, el trastorno límite de la personalidad, el síndrome de fatiga crónica y el síndrome del intestino irritable. Algunos neurotransmisores, especialmente la dopamina, la serotonina y la norepinefrina tienen una función reguladora del eje HHA. La oxitocina (OX) inhibe la secrección de ACTH mientras que la AVP actúa liberándola.
Modelos animales
El pez cebra se ha postulado como un modelo prometedor para las enfermedades neuropsiquiátricas complejas. Y ello por (1) manifestar una elevada fecundidad, pequeño tamaño y fácil mantenimiento, (2) presentar un fenotipos conductual bien definidos, siendo un animal social con jerarquías y comportamiento complejo, (3) poseer un eje hipotalámico-pituitario-interrenal (HPI), el cual, se encarga de la respuesta al estrés y cuyos órganos primarios (hipotálamo, hipófisis y corteza suprarrenal) cumplen con funciones y estructuras muy similares al sistema HHA humano [1] y (4) por que cerca del 70% de los genes humanos tienen un análogo en el pez cebra [2].
En tal especie, el gen sam2 se expresa únicamente a nivel cerebral, especialmente en las neuronas dorsales de la habénula, telencéfalo e hipotálamo. Los peces zebra con desactivación del gen sam2 (sam2 KO) mostraron que no se presentaban alteraciones en la embriogénesis, supervivencia en la etapa adulta ni infertilidad. Sí se observó alteraciones en el fenotipo conductual con mayor presencia de ansiedad y miedo con una mayor búsqueda de proximidad social. Los peces cebra sam2 KO mostraron mayores índice de hormona liberadora de corticotropina b (crhb) marcador de desregulación del eje HPI [3]. Igualmente se ha observado una reducción en la preferencia por la novedad social (aproximación a individuos desconocidos) [4].
Se ha documentado que los estados de miedo y ansiedad se relacionan con la sobrexpresión CRH mRNA por el incremento de la excitabilidad de las neuronas del núcleo paraventricular en los mamíferos. Los ratones sam2 KO manifiestan idénticos resultados a los peces zebra [3]. Por otro lado, ratones con desactivación específica de la hormona liberadora de corticotropina hipotalámica (Sim1CrhKO) manifestaron un fenotipo de baja ansiedad [5]. Igualmente la administración de la proteína sam2 incrementa la inhibición post-sináptica de las neuronas CRH nucleoparaventriculares por modulación GABAérgica [3].
Un trabajo previo [6] ya había mostrado que, en los macacos rheus, el antagonismo de los receptores CRH1 con antalarmín reducía las respuestas de ansiedad y miedo manteniendo la conducta de exploración y sexual. Sin embargo el uso de pexacerfont, antagonista selectivo de los receptores CRH1, no mostró, en humanos, resultado superiores al placebo en el tratamiento del trastorno de ansiedad generalizada [7] . Spierling, S.R y Zorrilla,E.P [8] analizan las posibles causas de esta disfunción entre modelos.
Otras líneas de trabajo se han centrado en OX y AVP. Clásicamente ambos nonapéptidos se han asociado al comportamiento social y sus alteraciones y en los últimos años se han establecido como dianas terapéuticas para el autismo, la adicción, la esquizofrenia, la depresión y los trastornos de ansiedad [9] algunas de ellas altamente prevalentes en la discapacidad intelectual. Trataremos de ello en posteriores entradas.
Bibiografía
1.- Avila, L.C. Efecto de la exposición a estrés crónico en la expresión de genes asociados al comportamiento ansiogénico sam2 y nlgn1 en pez cebra (Danio rerio). Tesis presentada como requisito para optar al título de Microbiologa. Universidad de los Andes. Facultad de Ciencias. Departamento de Ciencias Biológicas. Bogotá, Colombia. 2021. https://repositorio.uniandes.edu.co/bitstream/handle/1992/52908/25136.pdf?sequence=1
2.- Howe, K et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 2013; 496(7446): 498–503. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3703927/
3.- Choi, J.H. et al. Targeted knockout of a chemokine-like gene increases anxiety and fear responses. PNAS | Published online January 16, 2018 | E1041–E1050. https://www.pnas.org/content/pnas/115/5/E1041.full.pdf.
4.- Ariyasiri, K., Choi, T, Kim, O., Hong, T.I., Gerlai, R. y Kim, C. Pharmacological (ethanol) and mutation (sam2 KO) induced impairment of novelty preference in zebrafish quantified using a new three-chamber social choice task. Prog Neuropsychopharmacol Biol Psychiatry. 2019;88:53-65. https://pubmed.ncbi.nlm.nih.gov/29958859/
5.- Zhan, R., Asai, M., Mahoney, C.E., Joachim, M Shen, Y., Guner, G. y Majzoub, J.A. Loss of hypothalamic corticotropin-releasing hormone markedly reduces anxiety behaviors in mice. Mol Psychiatry. 2017; 22(5):733-744. https://www.nature.com/articles/mp2016136
6.- Habbib, K.E. et al. Oral administration of a corticotropin-releasing hormone receptor antagonist significantly attenuates behavioral, neuroendocrine, and autonomic responses to stress in primates. PNAS. 2000; 97 (15): 6079-6087.https://www.pnas.org/content/pnas/97/11/6079.full.pdf.
7.- Coric, V. et al. Multicenter, randomized, double-blind, active comparator and placebo-controlled trial of a corticotropin-releasing factor receptor-1 antagonist in generalized anxiety disorder. Depress Anxiety. 2010 May;27(5):417-25. https://pubmed.ncbi.nlm.nih.gov/20455246/
8.- Spierling, S.R y Zorrilla,E.P. Don’t stress about CRF: Assessing the translational failures of CRF1 antagonists. Psychopharmacology (Berl). 2017; 234(9-10): 1467–1481. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5420464/pdf/nihms857864.pdf
9.- Cid-Jofré, V., Moreno, M., Reyes-Parada, M., Renard, G.M. Role of Oxytocin and Vasopressin in Neuropsychiatric Disorders: Therapeutic Potential of Agonists and Antagonists. Int. J. Mol. Sci. 2021, 22, 12077. https://www.mdpi.com/1422-0067/22/21/12077/htm
Saber más
Arroyo, P. (18/03/2016). Hipotálamo, depresión, receptores de glucocorticoides, cortisol, corticosterona, adrenales. Blog NeuronUP. https://blog.neuronup.com/estres-perspectiva-fisiologica/
Muñoz-Collado, S. (28/06/2021). El Sistema Neuroendocrino: hipotálamo, hipófisis y su funcionamiento. Psicoactiva. https://www.psicoactiva.com/blog/sistema-neuroendocrino-funcionamiento/
En esta entrada se expondran los conceptos básicos de farmacoepidemiología y estudios de utilización de medicamentos.
Por farmacoepidemiología se entiende la aplicación de los conocimientos, métodos y razonamiento de la epidemiología al estudio de los efectos –positivos y negativos– y usos de los fármacos en grupos de poblaciones..
Su desarrollo se ha centrado por una parte en el estudio de la seguridad de los fármacos (reacciones adversas), sobre todo durante la etapa de poscomercialización (farmacovigilancia) y por otra en el ámbito de los estudio de utilización de medicamentos (EUM).
El EUM es definido por la OMS como “estudios sobre comercialización, distribución, prescripción y uso de los medicamentos en la sociedad, con acento especial sobre las consecuencias médicas, sociales y económicas”. Su objetivo último es el de optimizar la prescripción farmacéutica.
De forma más concreta el Drug Utilization Rechearh Group (DURG) define los EUM como “los trabajos de investigación sobre los aspectos cuantitativos y cualitativos de los determinantes del uso de medicamentos y de sus efectos, en pacientes específicos o en la población general”
Para poder establecer comparaciones entre estudios el DURG establece, basandose en el princicio activo, el sistema Clasificación anatómica-terapéutica-química (ATC) y una unidad técnica internacional de medida del consumo de medicamentos denominada Dosis Diaria Definida (DDD).
La clasificación ATC consta de 5 niveles:
1.- Primer nivel. Define el grupo anatómico principal. Se designa con una letra del alfabeto (A, B, C, D, G, H, J, L, M, N, P, R, S, V). Cada una se refiere al sistema orgánico sobre le que el medicamento ejerce sus acciones principales.
2.- Segundo nivel. Define el grupo terapéutico principal. Está formado por un número de 2 dígitos.
3.- Tercer nivel. Define el subgrupo terapéutico. Está formado por una letra del alfabeto.
4.- Cuarto nivel. Identifica el subgrupo químico/terapéutico. Está formado por una letra del alfabeto.
5.- Quinto nivel. Identifica específicamente un principio activo. Está constituido por un número de 2 dígitos, y es específico de cada principio activo.
Las DDD corresponden a las dosis media diaria habitual de un medicamento cuando se utiliza para su indicación principal en adultos. Por lo general se hará referencia a la dosis de mantenimiento no a la de profilaxis o de choque. Si el principio activo tiene varias vías de administración se diferenciará la DDD para cada una de ellas si son distintas.
En la página web https://www.whocc.no/atc_ddd_index/ se puede obtener a partir el código ATC y las DDD a partir de principio activo. Si introducimos el clásico haloperidol nos informa:
ATC: N05AD01 N (Sistema nervioso) 05 (Psicolépticos) A (Antipsicóticos) D (Derivados de la butirofenona) 01 Haloperidol,.
DDD: nos informará de las distintas dosis de mantenimiento en adultos para su indicación principal (psicosis). Así es de 8mg en vía oral o parenteral y de 3,3 en liberación depot (lenta y prolongada).
1.- Alvarez Luna F. Farmacoepidemiología. Estudios de Utilización de Medicamentos. Parte I: Concepto y metodología. Seguim Farmacoter 2004; 2(3): 129-136.
2.- Ruiz, D. (2011). Estudio de utilización de medicamentos. Cuestión de recursos, economía y salud. Farmacia Profesional, 1, 28-35.